《神秘的 “0 号元素”:探索化学世界的未知领域》
在我们所熟知的化学世界中,元素周期表就如同一张神秘的藏宝图,引领着我们探索物质的奥秘。自门捷列夫提出元素周期律以来,已知的 118
个元素构成了丰富多彩的物质世界。然而,在这个看似完整的元素周期表中,是否还隐藏着不为人知的神秘元素呢?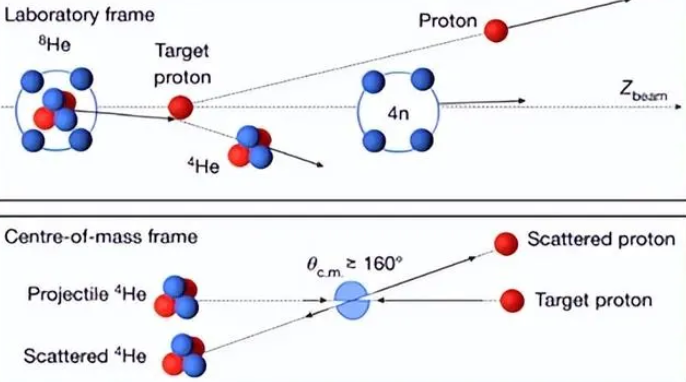
让我们从原子的结构说起。原子由原子核和核外电子组成,是化学反应中的最小单位。原子核又由质子和中子通过强相互作用力结合而成。质子数决定了元素的化学性质,是区分元素种类的重要标志。
提到元素周期表中的 1 号元素氢,大家都并不陌生。氢在自然界中含量丰富,水就是由氢和氧组成的。氢核素中丰度最高的是 1H,由一个质子和一个核外电子组成。当 1H 原子失去核外电子时,氢离子就等同于游离的质子,这体现了质子的化学性质。
而神秘的 “0 号元素” 又是怎么回事呢?元素周期表中确实没有 “0 号元素”,但这并不意味着它不存在。如果没有中子的质子可以单独作为一个元素,那么没有质子的中子为什么不可以呢?于是,“0 号元素”,即中子元素,被提了出来。早在 20 世纪初,物理学家安德罗波夫就将自由中子命名为 “0 号元素”,置于元素周期表中氦元素的正上方。
“0 号元素” 源于恒星的衰老过程。衰老的恒星坍塌时产生极大压力,将氢元素核外电子压入质子内部,形成电中性的中子粒子。目前,“0 号元素” 主要存在于质量极大的中子星内部,在这种高压环境下得以稳定存在。在常态环境下,我们很难探索其化学性质。虽然 20 年前就有研究表明可能存在四中子的无电荷核系统,但当时存在争议。如今,随着科学技术的进步,已有确凿实验证据证明四中子核系统的存在,关于 “0 号元素” 相关性质的研究仍在探索阶段。
这也引发了我们的思考:既然 “0 号元素” 存在,会不会还有其他元素周期表中未记录的新元素呢?原子核内部复杂的相互作用决定了原子核的稳定存在。以原子序数 26 的铁元素为界限,元素稳定性先增大后减小。近代新元素的发现集中在原子序数大于 110 的超重元素,这些超重元素可通过原子对撞人工合成,但具有放射性且寿命较短。2010 年,117 号元素被合成后,元素周期表第七周期正式填满。此后,科学家们在探索第八周期元素的道路上从未停歇。虽然目前尚未有第八周期的新元素被承认,但研究人员相信,通过更系统地研究微观粒子相互作用,可以提出新的合成方法,实现到达超重元素 “稳定岛”,开辟元素周期表的新纪元。
化学的世界充满了未知与惊喜,每一个新元素的发现都可能为我们打开一扇通往新领域的大门。我们期待着未来更多神秘元素的揭开,为我们进一步理解物质世界提供新的视角和契机。介绍一下安德罗波夫提出“0 号元素”的背景和过程元素周期表中的 0 号元素是否可以单独存在?宇宙中存在哪些自然条件可以产生“0 号元素”?








